Естественно-научные основы строительства. Химические основы
В строительстве большое количество разных строительных материалов с помощью определенных технологий превращается в здание или сооружение. Это требует знаний о свойствах строительных материалов и о процессах, происходящих при их переработке. Основой для этого являются такие естественные науки, как Физика, Химия, а также Электротехника. При возведении здания или сооружения необходимо учитывать большое число химических и физических процессов.
Химические основы
Химия занимается построением, составом, изготовлением и свойствами материалов, а также их превращениями и происходящими при этом процессами.
Тело и вещество
Каждое тело, будучи твердым, жидким или газообразным, занимает пространство. Там, где находится одно тело, не может находиться одновременно второе тело. Каждое тело состоит из одного определенного вещества, называемого также материей. Понятия «тело» и «вещество» пересекаются и поэтому применяются часто однозначно (рис. 1).
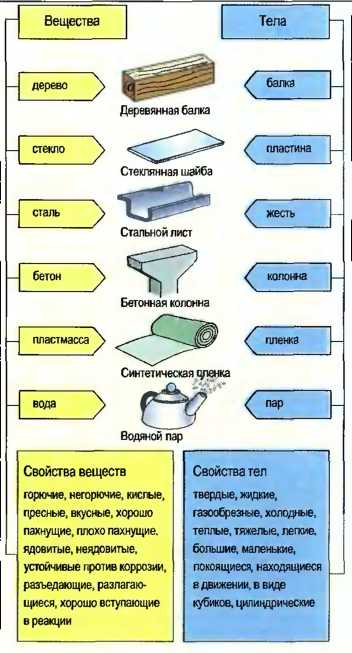
Рис. 1. Тела и вещества (примеры)
Каждое тело занимает определенное пространство и состоит из определенного вещества. Каждое вещество занимает пространство и образует, таким образом, тело. Тела и вещества могут различаться по своим свойствам.
Свойства тел в основном включают:
- форму агрегатного состояния;
- объем;
- энергетическое состояние.
Свойства веществ в основном включают:
- способность к реакциям с другими веществами;
- запах и вкус;
- устойчивость против коррозии.
Физика занимается состоянием тел и изменением их агрегатных состояний при физических процессах. Состав веществ при этом не изменяется. Химия занимается веществами, их составом и свойствами, а также вещественными изменениями при химических процессах.
Химические и физические процессы
Химический процесс
При химических процессах из одного или нескольких исходных материалов получаются новые вещества с полностью другими свойствами, отличными от исходных веществ (рис. 2). При Химических процессах возникает новое вещество.
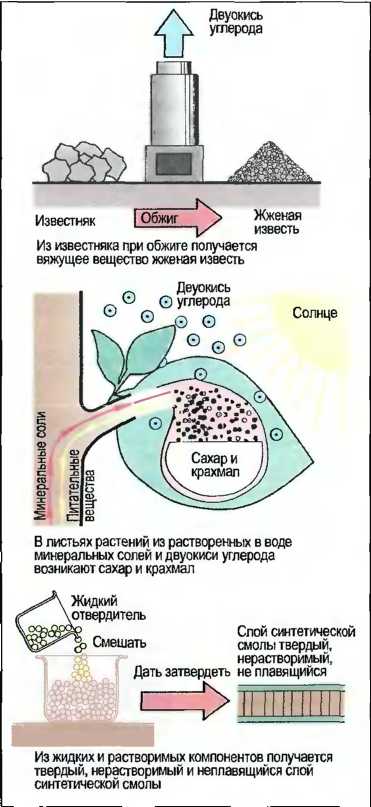
Рис. 2. Химические процессы (примеры)
Физический процесс
При Физических процессах не возникает новое вещество. Изменяется агрегатное состояние, положение или величина вещества или тела (рис. 3). При физическом процессе изменяется состояние вещества, вещество остается прежним.
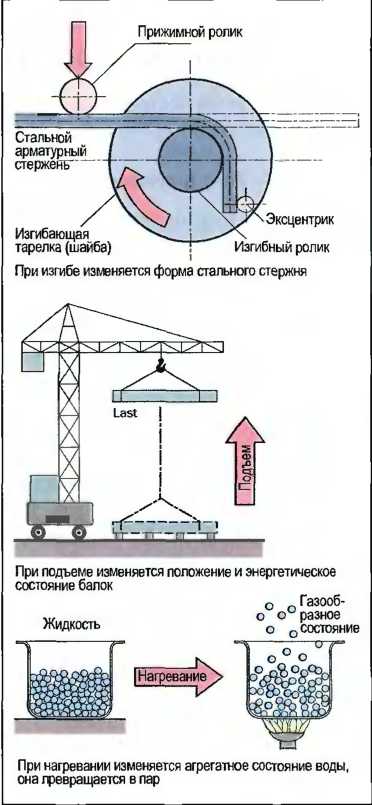
Рис. 3. Физические процессы (примеры)
Виды материалов
По составу материалов различаются смеси или смеси материалов, химические соединения и элементы или основные вещества.
Смеси
Состоят из многих различных отдельных материалов. Смеси, например известковый раствор, позволяют с помощью физико-механической технологии разложить себя на отдельные вещества — песок, воду и известь (рис. 4). Физико-механические методы разделения — это, например, дистилляция, выпаривание, фильтрование и отстаивание.
Химические соединения
Состоят, по меньшей мере, из двух различных основных веществ или элементов. Химические соединения не могут быть разложены на отдельные элементы с помощью физико-механических процессов. Только с помощью химических методов можно разложить их на отдельные элементы, как, например, двуокись кальция на кальций, кислород и водород (см. рис. 4).
Химические элементы
Называемые также основными веществами, это вещества, которые не могут быть разложены на составляющие ни с помощью физико-механических, ни с помощью химических методов, как, например, кремний и кислород (см. рис. 4).
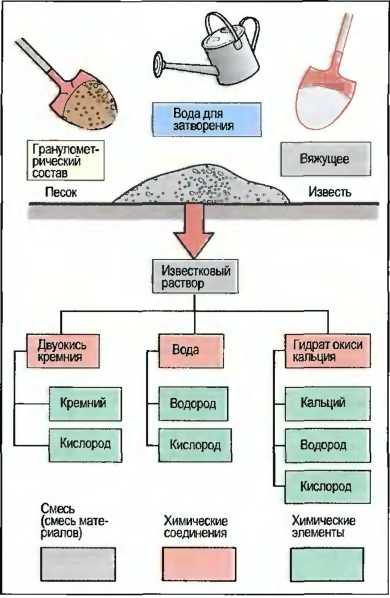
Рис. 4. Виды веществ
Химические элементы
Вещества, которые не могут больше быть разложены на отдельные элементы, называют химическими элементами или основными веществами. Существует 92 природных элемента, из которых состоят все вещества на Земле. 17 элементов получены искусственным путем. Из природных элементов 66 — металлы, 16 — неметаллы и 6 — полуметаллы. МЕТАЛЛЫ блестят и являются хорошими проводниками электрического тока и тепла. НЕМЕТАЛЛЫ в основном газообразные, преимущественно диэлектрики и плохие проводники тепла, как, например, сера. ПОЛУМЕТАЛЛЫ могут иметь как металлические, так и неметаллические свойства, как, например, кремний и селен.
Элементы обозначаются в основном краткими обозначениями, которые являются производными от их греческого или латинского названия (табл. 1).
| Таблица 1. Наименование и краткое обозначение важнейших элементов | |
| Название | Краткое обозначение |
| Металлы | |
| Алюминий | Al |
| Свинец | Рb |
| Хром | Сr |
| Железо | Fe |
| Золото | Au |
| Калий | К |
| Кальций | Са |
| Кобальт | Со |
| Медь | Сu |
| Магний | Mg |
| Марганец | Мn |
| Молибден | Mо |
| Натрий | Na |
| Никель | Ni |
| Ниобий | Nb |
| Платина | Pt |
| Ртуть | Hg |
| Серебро | Ag |
| Тантал | Ta |
| Титан | Ti |
| Ванадий | V |
| Вольфрам | W |
| Цинк | Zn |
| Олово | Sn |
| Неметаллы | |
| Аргон | Аr |
| Хлор | Cl |
| Фтор | F |
| Гелий | Не |
| Углерод | С |
| Неон | Ne |
| Фосфор | Р |
| Кислород | О |
| Сера | S |
| Азот | N |
| Водород | Н |
| Полуметаллы | |
| Кремний | Si |
| Селен | Se |
Химические элементы состоят из атомов. Атомы определенных элементов одинаковы друг с другом. Различные свойства элементов поэтому объясняются различным строением их атомов (рис. 5).
Атомы
Мельчайшие частички материи, расчленение которых невозможно физическими или химическими методами, называются атомами. Атомы так малы, что они невидимы. Поэтому строение атомов и процессы, происходящие в атомах, люди представляют с помощью моделей. По модели датского естествоиспытателя Нильса Бора (1885—1962) атомы имеют шарообразное строение и состоят из оболочки атома и атомного ядра (см. рис. 5).
- Диаметр атомной оболочки — 0,0000001 мм.
- Диаметр атомного ядра — 0,000000000001 мм (рис. 6).
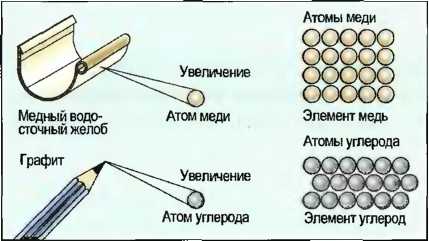
Рис. 5. Атомы в химических элементах
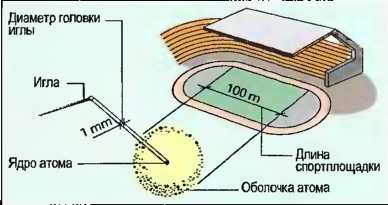
Рис. 6. Модель атома в сравнительных размерах
Атомное ядро
- Находится в центре атома.
- Заключает в себе почти всю массу атома.
- Состоит из нуклонов или кирпичиков атомного ядра.
Нуклоны подразделяются на протоны, заряженные положительным электрическим зарядом, и нейтроны, которые электрически нейтральны. Ядра атомов могут состоять из нескольких протонов и нейтронов (рис. 7).
- Массовое число или число нуклонов равно числу протонов и нейтронов в атоме.
- Порядковое число или величина заряда ядра равно числу протонов в атомном ядре.
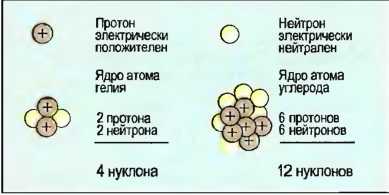
Рис. 7. Строение атомного ядра
Атом гелия или элемент гелий имеет порядковое число 2 и массовое число 4. Атом углерода или элемент углерод имеет порядковое число 6 и массовое число 12 (рис. 8).
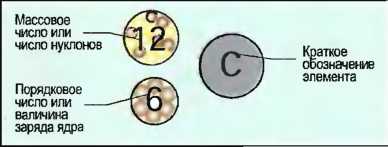
Рис. 8. Обозначение углерода
Оболочка атома
Оболочка атома образована электронами. Они вращаются с большой скоростью в шарообразной области вокруг атомного ядра. Эту область называют электронной оболочкой атома (рис. 9).
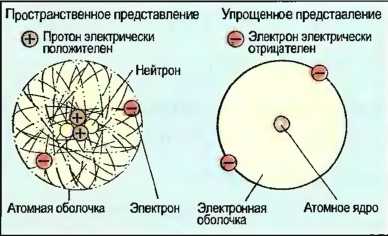
Рис. 9. Модель атома гелия
Электроны имеют отрицательный электрический заряд и обладают очень малой массой. Отрицательный заряд соответствует по величине положительному заряду протонов в ядре атома. В атоме число электронов и протонов одинаково, атом по отношению к внешней среде является электрически нейтральным. С помощью противоположных по знаку зарядов электроны удерживаются на своих орбитах.
Электроны группируются в электронные оболочки, которых вокруг ядра может быть до семи. Они находятся от ядра на различных расстояниях. В каждой электронной оболочке может быть определенное максимальное число электронов. Во внутренней оболочке может быть 2 электрона, во второй — 8, в третьей — 18, однако во внешней оболочке их может быть тоже 8 (рис. 10).
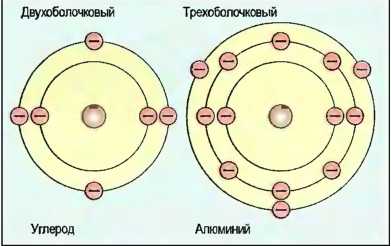
Рис. 10. Изображение многооболочкового атома
Атомная массa
При определении массы атома очень малая масса электронов не учитывается. Масса атома водорода или протона составляет 1,67*10-24 г. Эта величина очень мала. Поэтому ее заменяют числом 1,008 или 1. Так как масса протона равна массе нейтрона, то атомная масса других элементов во много раз больше этого числа. Поэтому ее называют относительной атомной массой (массовым числом). Относительная атомная масса атома кислорода с 16 нуклонами составляет 15,999 или 16 (табл. 2).
| Таблица 2. Относительная атомная масса некоторых элементов | |
| Элемент | Атомная масса |
| Водород | 1,008 |
| Углерод | 12,001 |
| Азот | 14,007 |
| Кислород | 15,999 |
| Алюминий | 26,98 |
| Кальций | 40,08 |
| Железо | 55,85 |
| Свинец | 207,19 |
При одинаковом количестве атомов какого-либо элемента, а именно при 6,02205 * 1023 (1 Моль), относительная атомная масса соответствует его атомной массе в граммах (молярная масса).
Изотопы
Атомы определенного элемента, например углерода, имеют одинаковое число протонов. Однако число нейтронов может быть разным (рис. 11).
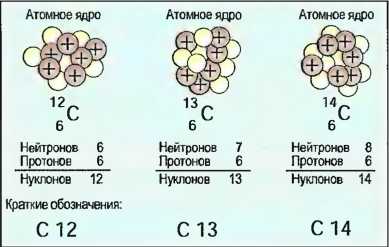
Рис. 11. Изотопы углерода
Атомы одного и того же элемента с разным количеством нейтронов называют изотопами. Изотопы, например, углерода имеют одинаковые химические свойства, но разные массы. Почти все элементы образуют изотопы, но только в ограниченном количестве.
Радиоактивность
Изотопы некоторых элементов, например радия (Ra 226), урана (U 235), углерода (С 14), излучают энергию. При этом атомные ядра распадаются. Это свойство называется радиоактивностью. При этом различают альфа-, бета- и гамма-лучи (рис. 12). Альфа-лучи состоят из ядер гелия. Состоящие из электронов бета-лучи пронизывают стальные листы или свинцовые пластины толщиной до 1 мм. Гамма-лучи с очень малой длиной волны возникают при превращениях ядра. Они проникают через бетонные стены толщиной в метр и могут быть остановлены только очень толстыми свинцовыми листами. Они очень опасны для человека и приводят к разрушению тканей.
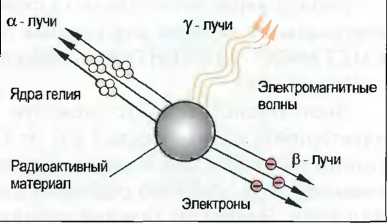
Рис. 12. Радиоактивное излучение
Радиоактивные материалы применяют в технике, например для контроля толщины материала при изготовлении бумаги, фольги, пленок и листовых металлических материалов.
Периодическая система элементов
Если исследовать свойства элементов в порядке их атомных зарядов, то можно заметить, что почти одинаковые свойства периодически повторяются через 8 элементов. При этом получается 7 строчек или периодов. Период 3, например, объединяет элементы от натрия до аргона (рис. 13).
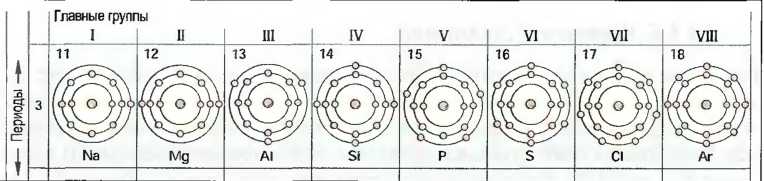
Рис. 13. Элементы периода 3 от 1 до 8 наружных электронов
Если расположить 7 периодов так, что элементы с одинаковыми свойствами будут стоять одни под другими, то получится 8 вертикальных колонок или главных групп от I до VIII (табл. 3).
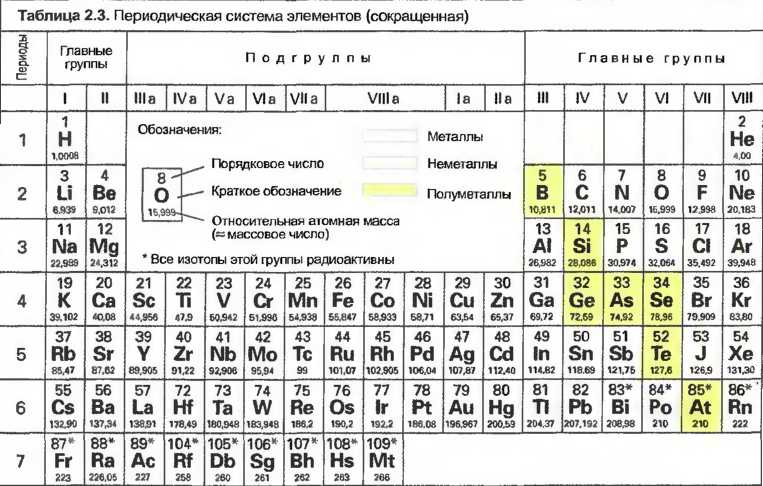
Расположение элементов по их свойствам в 7 горизонтальных периодов и 8 вертикальных колонок или главных групп называется Периодической системой элементов (созданной русским ученым Д.И. Менделеевым.).
Было установлено, что элементы главных групп содержат на внешней электронной орбите каждый раз от 1 до 8 электронов. Элементы главной группы 1 имеют всегда 1 внешний электрон. Они все — металлы, за исключением водорода, и сильно реагируют с неметаллами, как, например, кислород или хлор. Элементы главной группы VIII имеют на внешней орбите по 8 электронов. Они при комнатной температуре газообразные и не соединяются с другими элементами (инертные газы). Металлы находятся в левой части периодической системы, неметаллы — в правой. Между ними расположены полуметаллы. Периодическая система четко показывает, что свойства элементов зависят от количества электронов на их внешних орбитах.
Атомы элементов в подгруппах имеют 1 или 2 внешних электрона и различаются по количеству электронов на их внутренних орбитах. Свойства элементов в подгруппах имеют большое сходство, все они металлы (см. табл. 3).
Химические соединения
Различные атомы или элементы могут связываться между собой. Возникшее при этом новое вещество называют химическим соединением. Это новое вещество имеет совсем другие свойства, чем свойства элементов, из которых он состоит. Например, соединяются один атом кислорода (О) с двумя атомами водорода (Н) в одну молекулу воды (Н2O). Химическое соединение вода имеет другие свойства, чем элементы кислород и водород (рис. 14). Одна молекула — это мельчайшая частичка химического соединения. Молекулы одного химического соединения одинаковы. У многих элементов определенное количество атомов объединено в молекулы. Их называют элементарными молекулами, например кислород с двумя, а сера с шестью атомами. Только у инертных газов, например у гелия, имеются отдельные атомы (рис. 15). В металлических элементах атомы образуют кристаллоподобные соединения частичек (рис. 16). Количество атомов одного элемента в молекуле показывается в виде индекса (низко расположенного числа) около краткого обозначения элемента, причем индекс 1 отсутствует.
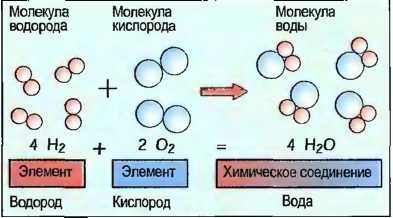
Рис. 14. Химические соединения (пример)
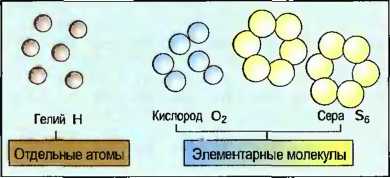
Рис. 15. Отдельные элементы и элементарные молекулы
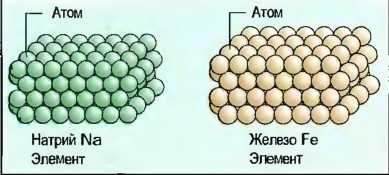
Рис. 16. Объединение частиц
Примеры:
- СН4 1 молекула метана состоит из 1 атома углерода и 4 атомов кислорода;
- NaCl 1 молекула хлорида натрия (поваренная соль) состоит из 1 молекулы натрия и 1 молекулы хлора.
При химических соединениях атомы связываются различным образом. Различают образование электронных пар, образование ионов и образование металов.
Образование электронных пар
Элементы, атомы которых на своих электронных орбитах полностью укомплектованы по 8 электронов, не имеют склонности соединяться с другими элементами. Они находятся в стабильном состоянии (инертные газы). Элементы, которые имеют только на 1 или 2 электрона меньше или больше 8 на своей внешней орбите, стремятся перейти в стабильное состояние, и поэтому очень активны в реакциях с другими элементами. Если, например, 4 атома водорода и 1 атом углерода соединяются вместе, то каждый атом путем приема или отдачи одного электрона из атомной оболочки другого наполнить свою оболочку. Это происходит за счет того, что каждый электрон внешней орбиты оболочки атома будет использоваться совместно, а именно парами будут крутиться вокруг атомных ядер, и тем самым они будут связаны в одну молекулу метана. Так как связь возникает с помощью совместных электронных пар, то такой вид связи называют соединением электронными парами (рис. 17).
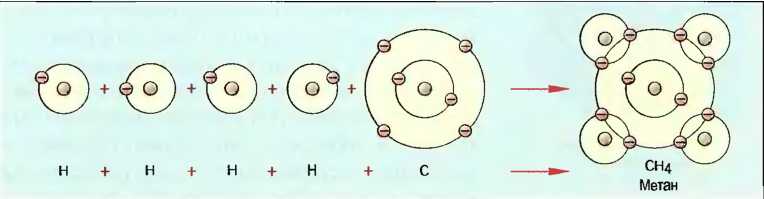
Рис. 17. Связь электронными парами
Ионная связь
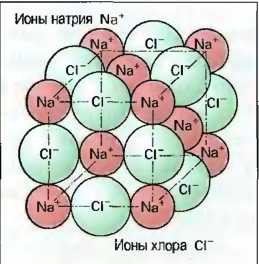
Если от атома отделяется один или несколько электронов, то его заряд становится положительным. Если, напротив, атом принимает электроны, то он становится электрически отрицательным. Возникшие при отдаче или приеме электронов положительные или отрицательные частички называют ионами, причем знак заряда обозначается знаками «плюс» или «минус» справа сверху от краткого обозначения. На пример, Na+ (положительно заряженный ион натрия) или С1 (отрицательно заряженный ион хлора). Число зарядов обозначается цифрой рядом со знаком. Например Аl3+ (троекратно положительно заряженный ион алюминия). Ионы с противоположными зарядами притягиваются друг к другу и поэтому могут связываться друг с другом. При образовании хлорида натрия (поваренная соль), например, атом натрия отдает свой внешний электрон атому хлора (рис. 18). При этом получается положительно заряженный ион натрия и отрицательно заряженный ион хлора, которые за счет своих противоположных зарядов притягиваются друг к другу и образуют химическое соединение хлорид натрия. Эту связь называют ионной связью. Она имеет место в основном в соединениях металлов и неметаллов (соли). Силы притяжения при ионной связи действуют не только между двумя ионами, но и по всем направлениям. При этом получается решетчатое, ионное образование. Этапостроенная по геометрическим законам пространственная решетка приводит к образованию прочных, ограниченных ровными плоскостями тел, называемых кристаллами (ионная кристаллическая решетка) (рис. 19).
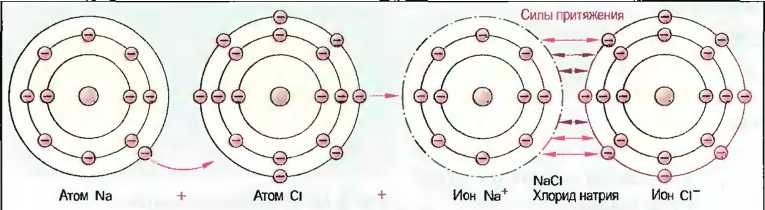
Рис. 18. Ионная связь
 /p>
/p>
Рис. 19. Кристалл поваренной соли
Соединения металлов
Атомы металлов обладают на их внешних орбитах в большинстве случаев только небольшим количеством электронов, которые при тесном расположении этих атомов отделяются от них с образованием прочного тела. При этом из атомов металлов получаются ионы металлов (рис. 20). Электроны перемещаются подобно газу свободно между ионами металлов, которые можно представить себе как шарообразные частички. За счет электрических сил сцепления они тесно прижимаются друг к другу, причем электроны удерживаются около них как на клею. Так как силы действуют во все стороны, то металлы образуют кристаллы (металлическая кристаллическая решетка).
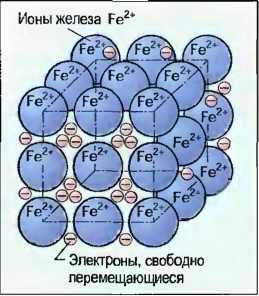
Рис. 20. Соединение металла (кристалл железа)
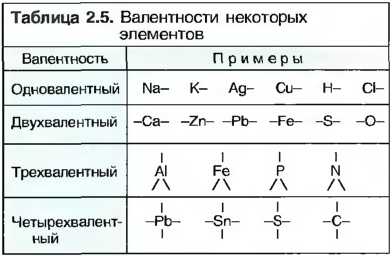
Валентность
Из каких элементов, и в каком соотношении эти элементы вступают в химические соединения, можно понять из химических формул. При этом различают суммирующие формулы и структурные формулы. В суммарных формулах краткие обозначения элементов в одном химическом соединении следуют одно за другим. Расположенные за краткими обозначениями внизу цифры показывают, в каком числовом соотношении содержатся атомы элементов в химическом соединении. В суммарных формулах каждый атом представлен отдельно. Они могут показывать порядок связи атомов в таких молекулах (табл. 4). В каком числовом соотношении атомы вступают в химические соединения, зависит от того, сколько внешних электронов они могут отдать, принять или взять в совместное использование. Это число называют валентностьюэлемента, а обменные электроны называют валентными электронами. В структурных формулах валентность обозначают числом валентных штрихов (табл. 5).
| Таблица 4. Виды формул | |||
| Вещество | Формула | Составляющие части | |
| суммарная | структурная | ||
| Вода | H2O | H-O-H | 2 атома Н, 1 атом O |
| Формальдегид | HCHO | Н-С=O-H | 1 атом С, 2 атома Н, 1 атом О |
| Тетрахлоруглерод | ССl4 | Cl-CClCl-Cl | 1 атом С, 4 атома CI |
Химические уравнения
При химических процессах массы веществ перед химическим процессом равны массам материи после процесса. Химические процессы, называемые также химическими реакциями, можно представить в виде химических уравнений или уравнений реакций. В химических уравнениях знак равенства заменяется стрелкой. С левой стороны уравнения располагаются исходные материалы, справа — вещества, полученные после реакции (конечные вещества). Количество атомов слева от стрелки должно соответствовать количеству атомов справа от стрелки. Если расчет показывает, что необходимо выравнивание, это производится соответствующей цифрой перед кратким обозначением (рис. 21)
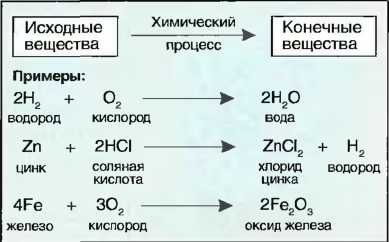
Рис. 21. Химическое уравнение
Синтез, анализ
Под термином синтез понимают создание химического соединения. Получение синтетических материалов, например пластиков, является основной задачей химической промышленности. Разложение химических соединений на их элементы называют анализом. Синтез и анализ — это химические процессы Они могут быть представлены химическими уравнениями (рис. 22).
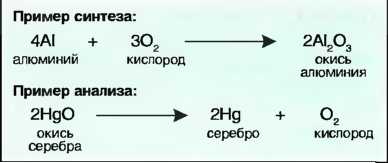
Рис. 22. Синтез и анализ
Смеси
Некоторые материалы можно по желанию смешивать. При этом они не будут вступать в химические реакции. Полученная смесь или смесь материалов не является новым веществом. Поэтому ее можно разделить на исходные материалы с помощью физических процессов, например с помощью дистилляции, выпаривания, фильтрования, магнитного разделения или осаждения. Смесями являются, например, растворы, дисперсии и легирования.
Растворы
Многочисленные твердые, жидкие и газообразные материалы могут так тонко распределяться в жидкостях, что в них будут существовать только отдельные молекулы. Тогда говорят, что вещество находится в растворенном состоянии или в растворе. Жидкость называют растворителем (рис. 23). Определенное количество растворителя при определенной температуре может растворить только определенное количество вещества. Если это количество достигнуто, то раствор насыщается. Раствор, приближающийся по концентрации к насыщенному, называется концентрированным, а раствор, далекий от состояния насыщения, называется разбавленным. Процесс растворения может быть ускорен при размельчении растворяемого вещества, а также при помешивании или нагревании. Растворенные твердые вещества могут выделяться из растворов с помощью испарения растворителя, например при обмазке холодной битумной мастикой.

Рис. 23. Раствор
Для разделения двух растворенных друг в друге жидкостей раствор подвергается дистилляции (перегонке). При этом раствор доводится до кипения. Более легко испаряющаяся жидкость выкипает и с помощью охлаждения снова превращается в жидкость. Жидкость, которая испаряется труднее, остается в сосуде (рис. 26). Разделение нескольких растворенных друг в друге жидкостей производится многократной дистилляцией, причем жидкости испаряются в соответствии с их точкой кипения, пар отводится в отдельный сосуд и там охлаждается. При этом говорят о фракционной дистилляции, например разделение сырой нефти на бензины, мазуты, смазочные масла и битумы.
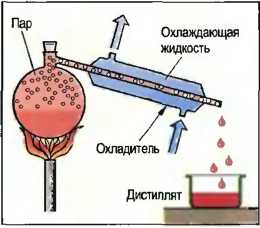
Рис. 26. Дистилляция
Дисперсия
При дисперсии очень маленькие частички вещества распределяются очень тонко в жидкости, не растворяясь в ней. Такую жидкость называют дисперсионной. Если тонко распределенное вещество является твердым, то дисперсию называют суспензией, например бетонит (рис. 24). Если это жидкость, то говорят об эмульсии, например битумная эмульсия (рис. 25). В дисперсиях тонко распределенные в жидкости частички со временем осаждаются, и наступает частичное расслоение. Поэтому перед употреблением их надо встряхивать или перемешивать. Примерами могут служить дисперсионные клеи и дисперсионные краски, а также сверлильные эмульсии из нефти и воды для обработки металлов.
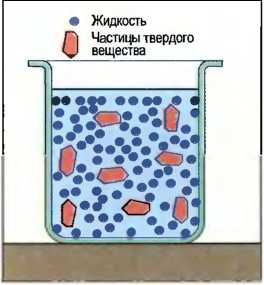
Рис. 24. Суспензия
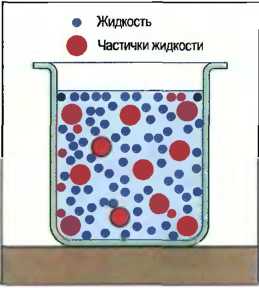
Рис. 25. Эмульсия
Легирование
Многие металлы в расплавленном состоянии растворяются друг в друге. Затвердевший раствор называют легированием. Свойства легированного металла очень часто значительно отличаются от свойств исходных металлов, например по их прочности, твердости и их температуре плавления. С помощью легирования можно создавать материалы с определенными свойствами. Так, например, сталь с присадками хрома и никеля становится устойчивой против коррозии.
Важнейшие основные материалы и их соединения
Большинство строительных материалов — это смеси из различных химических соединений, которые, в свою очередь, состоят из элементов. Наряду с элементами углеродом (С), водородом (Н) и кислородом (О) строительные материалы и вяжущие содержат калий (Ка), кальций (Са), кремний (Si), алюминий (А1) и железо (Fe). Синтетические материалы в основном содержат хлор (С1) и азот (N) (рис.27).
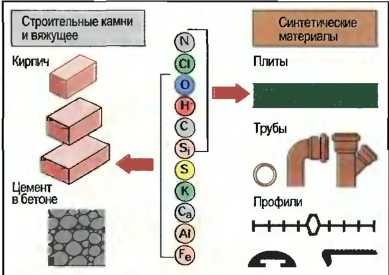
Рис. 27. Строительные материалы и составляющие их элементы
Кислород (О)
Свойства: Кислород без запаха, без вкуса, бесцветный газ тяжелее воздуха. Он необходим для горения и для дыхания, но сам не горит. В чистом кислороде сгорают многие вещества, даже металлы, быстро и полностью. Происхождение: Почти 21% воздуха составляет свободный кислород. Большая часть кислорода содержится в каменной массе земной коры и в воде в химически связанном состоянии. Кислород выделяется растениями с помощью фотосинтеза из углекислого газа (рис. 28).
Применение: Кислород применяется при сварке и резке металлов, для производства стали и в качестве кислородного разделителя бетона и заполнителя.
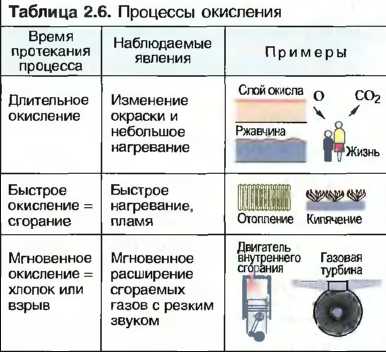
Окисление, восстановление (раскисление)
Когда вещество соединяется с кислородом, то говорят об окислении, а возникшее при этом вещество называют оксидом или окислом. При любом окислении выделяется тепло. Окисление может происходить быстро или медленно по времени. Если у окисла отнимается кислород, то говорят о восстановлении (раскислении). Для раскисления необходимо тепло. Получение многих металлов из их руд происходит путем восстановления.
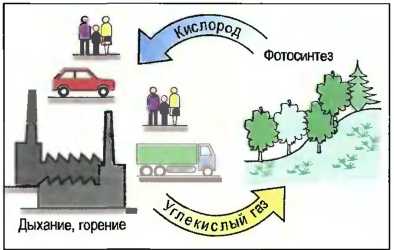
Рис. 28. Воспроизводство кислорода
Водород (Н)
Свойства: Водород — бесцветный газ без запаха. Он является самым легким из всех веществ. 1 литр весит 0,09 г. Смесь водорода и кислорода в соотношении 2:1 очень взрывоопасна. Происхождение: Водород в чистом виде в природе не встречается, однако в химически связанном виде он присутствует во многих ископаемых горючих веществах и в воде. Необходимый для промышленности водород получается из нефти или природного газа. Применение: Водород находит применение в химической промышленности и в сварочной технике.
Углерод (С)
Происхождение: Углерод в природе в чистом виде встречается в виде графита и алмаза. В химически связанном виде он присутствует в каменных частях земной коры, например в виде известняка (СаСОэ), и в растительных остатках, например в каменном угле, в нефти и природном газе. Наряду с этим он является составной частью биомассы растений и животных. В виде углекислого газа он присутствует в воздухе и находится в растворенном виде в воде (рис. 29). Свойства: Графит — это мягкое, черное, блестящее красящее вещество. Алмаз бесцветен, стекловиден, очень тверд и хрупок.
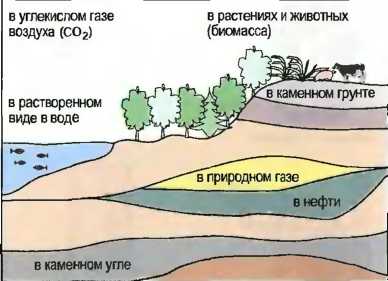
Рис. 29. Местонахождение углерода в природе
Применение: Технически полученный углерод служит коксом для получения железа, сажей для наполнителя при производстве резины, в качестве углеродных волокон для упрочнения пластмасс и в качестве алмазов для обкладки сверл по камню. Алмаз в порошковой форме применяется в качестве шлифовального средства, например для дисковых пил, или в качестве полировального средства (рис. 30).
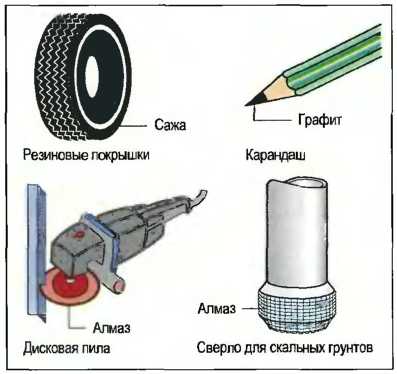
Рис. 30. Применение углерода (примеры)
Соединения углерода
Различают неорганические и органические соединения углерода. К неорганическим относятся угарный газ (СО), углекислый газ (С02), углекислота и ее соли, а также карбиды (рис. 31).
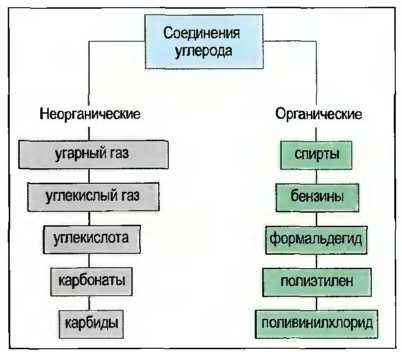
Рис. 31. Важнейшие соединения углерода
Неорганические соединения углерода:
- Угарный газ (СО) получается при сжигании углеродосодержащих материалов при недостаточном снабжении кислородом. Это бесцветный газ без запаха. Он очень ядовит и горит синим пламенем. Он используется в большой технике для производства многих материалов, например пластмасс и растворителей.
- Углекислый газ (С02) получается при сжигании углеродосодержащих материалов. Это негорючий, бесцветный газ без запаха. Он не ядовит. Так как он почти в 1,5 раза тяжелее воздуха, он собирается в низких местах, например в подвалах и шахтах. Там имеется опасность задохнуться!
- Выделяющийся в больших количествах при сжигании ископаемых горючих материалов, например нефти и газа, углекислый газ ведет к нагреванию атмосферы (к созданию так называемого парникового эффекта в атмосфере Земли).
- Двуокись углерода в воздухе является причиной «кислотных дождей».
- Угарный газ вызывает отравление людей. Находясь в атмосфере углекислого газа, человек может задохнуться.
Органические соединения углерода Важными соединениями углерода являются углеводороды. По строению их молекул различают цепные, кольцеобразные, а также разветвленные углеводороды. В цепных углеводородах атомы углерода располагаются в ряд друг за другом, а свободные валентности заняты атомами кислорода (рис. 32). Цепи углеводородов, содержащие до 5 атомов С, — газообразны, например газ пропан С3Н8, с 6 до 15 атомов — жидкие, например октан С8Н18, и с 15 атомов С и более — пастообразные, до твердых, например стеарин С18Н36. Бензин — это смесь жидких углеводородов. Атомы углерода могут соединяться друг с другом посредством 2 или 3 валентностей. Их называют ненасыщенными. Ненасыщенными углеводородами являются, например, газы ацетилен и этилен (рис. 33). Простейшим кольцеобразным соединением углеводородов является бензол С6Н6. Другим производным соединением из бензола является фенол С6Н5ОН (рис. 34). Кольцеобразные ненасыщенные углеводороды являются важными исходными материалами для химической промышленности, например для производства пластмасс. Другими органическими соединениями углерода, содержащими наряду с водородом еще и другие химические элементы, такие, как, например, кислород, хлор и азот, являются спирты (алканолы), альдегиды (алканалы), органические кислоты (спиртовые кислоты) и хлорированные углеводороды (табл. 7).
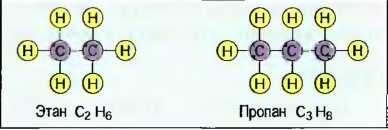
Рис. 32. Цепные углеводороды
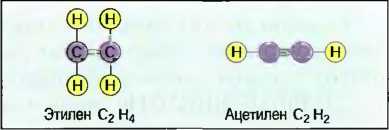
Рис. 33. Ненасыщенные углеводороды
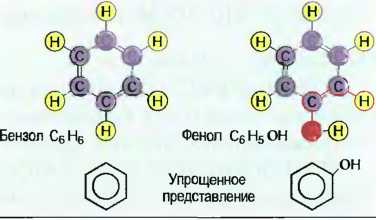
Рис. 34. Кольцеобразные углеводороды
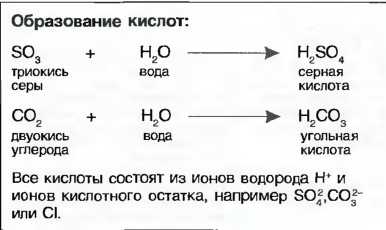
Кислоты
Кислоты получаются, когда оксиды неметаллов растворяются в воде, например угольная кислота (Н2СO3) или серная кислота (H2SO4).Также и соединения неметаллов (галогены) хлор и фтор с водородом при растворении в воде образуют соляную кислоту (НСl) или фтористую кислоту (HF). Их называют кислородными кислотами (рис. 35).
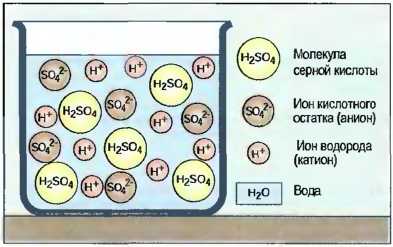
Рис. 35. Серная кислота (схематически)
Образование ионов Молекулы кислот могут в водных растворах полностью или частично расщепляться на водородные ионы (Н*) и остаточные ионы кислоты, например на ионы (SO4-2) или (СO3-2). Поэтому кислоты проводят электрический ток (электролиты). Кислородные ионы называют катионами, а ионы кислотного остатка — анионами.
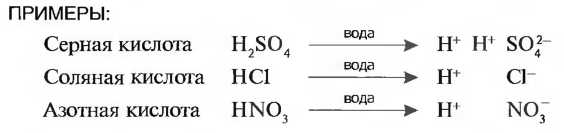
Свойства кислот определяются отколовшимися ионами водорода. Поэтому кислоты действуют только в водных растворах. Сила действия кислоты зависит от того, сколько ионов водорода отделилось.
Сильные кислоты: соляная кислота (НСl), азотная кислота (HNO3), серная кислота (H2SO4). Среднесильные кислоты: фосфорная кислота (Н3РO4), фтористая кислота (HF). Слабые кислоты: угольная кислота (Н2СO3), синильная кислота (HCN).
Важнейшие кислоты
Соляная кислота (НСl) разлагает известняк (СаСO3) при отделении двуокиси углерода (СO2). Разбавленная соляная кислота применяется для очистки (раскисления) кирпичной кладки и для удаления известковых отложений.
Серная кислота (H2SO4) как составляющая часть «кислотных дождей» образует вместе с не растворимыми в воде известняками (СаO3) водорастворимый сульфат кальция (CaSO4), который, как гипс, либо уносится вместе с водой, либо приводит к повреждениям строительных конструкций за счет кристаллизации «сульфатации» и связанным с ней увеличением объема и отслоением материала. Серная кислота сильно притягивает воду (она гигроскопична). Поэтому при разбавлении водой необходимо кислоту вливать в воду!
Угольная кислота (Н2СO3)образуется в основном соединением дымовых газов, содержащих СO2 с влажностью воздуха или с дождевой водой. Вода, содержащая угольную кислоту, разлагает содержащие известь вяжущие вещества. Угольная кислота при этом соединяется с известковой составляющей и образует водорастворимую соль — гидрогенкарбонат кальция (Са(НСO3)2).
Азотная кислота (HNO3)состоит из аммиака (NH3), который получается при разложении органических материалов, например в канализационных коллекторах или в хлевах сельскохозяйственных животных. Вместе с содержащими известь строительными материалами образуется растворимый в воде нитрат кальция (CaNO3), который известен как «стеновая селитра» и может привести к повреждениям строительных конструкций. Азотная кислота является сильным окислителем. При взаимодействии с органическими материалами, например с деревом или текстилем, эти материалы могут загореться.
Свойства:
- Кислоты окрашивают лакмусовую бумагу в красный цвет.
- Кислоты раздражают кожу и разрушают одежду.
- Кислоты реагируют с большинством металлов и со многими органическими веществами.
- Кислоты имеют кислый вкус.
- Кислоты могут привести к разрушениям строительных конструкций.
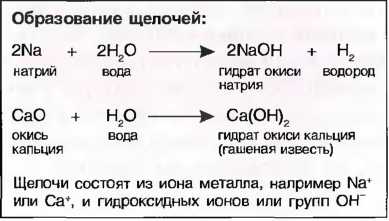
Щелочи
Щелочи получаются путем реакций щелочных металлов, например натрия (Na), или водорастворимых окислов металлов, например окись кальция (СаО), с водой. При выпаривании воды получают в большинстве случаев твердую бесцветную массу гидрата окиси металла, называемого также основанием. Однако щелочное действие наступает только тогда, когда гидрат окиси растворяется в воде (рис. 36).
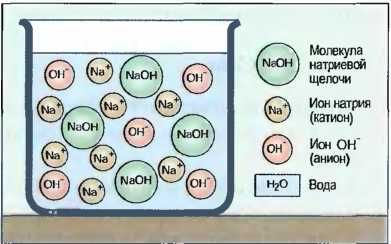
Рис. 36. Натриевая щелочь
Образование ионов Молекулы щелочи распадаются в водном растворе частично или полностью на положительно заряженные ионы металла, например на Na+ ионы (катионы) и отрицательно заряженные ионы ОН- (анионы).
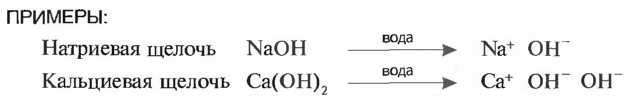
Щелочи проводят электрический ток и поэтому называются электролитами. Свойства щелочей определяются ионами ОН, причем количество отделившихся ионов ОН определяет силу щелочи. Сильными щелочами являются натриевая щелочь (NaOH), калиевая щелочь (КОН) и кальциевая щелочь (Са(ОН)2). Слабой щелочью является водный раствор газа — аммиака, который называется нашатырем (NH4OH). Гашеная известь - это натриевая щелочь. Она применяется для приготовления строительных растворов. Известковое молоко - это разбавленная водой гашеная известь.
Величина pH На практике часто требуется установить, насколько сильным является раствор как кислота или основание. Мерой этому служит величина pH. Она может меняться от 0 до 14 (рис. 37). Водный раствор с величиной pH = 7 является нейтральным. Такую величину pH имеет дистиллированная вода. Растворы с величиной pH от 0 до 7 являются кислыми, чем меньше величина pH, тем кислее раствор. Растворы с величиной pH от 7 до 14 являются основными, чем больше величина pH, тем более основным или щелочным является раствор. Величину pH раствора определяют с помощью индикаторной (лакмусовой) бумажки или с помощью индикаторных растворов, а также с помощью электроприборов. Серная кислота имеет величину pH = 1, углекислота имеет pH = 4. Величина pH гашеной извести составляет 12, натриевой щелочи — 13.
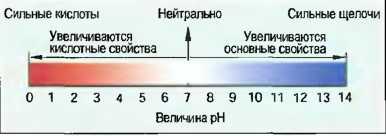
Рис. 37. Шкала величин pH
Свойства:
- Щелочи окрашивают лакмусовую бумажку в синий цвет.
- Щелочи раздражают кожу и разрушают одежду.
- Щелочи растворяют жиры, некоторые щелочи растворяют растительные и животные ткани.
- Щелочи взаимодействуют с некоторыми металлами, например с алюминием.
- Щелочи — мыльные на ощупь.
- Щелочи защищают сталь от коррозии.
Кислоты и щелочи опасны, они могут храниться только в четко обозначенных этикетками сосудах, ни в коем случае не в сосудах из-под напитков. При работе с кислотами и щелочами нужны защитные очки.
Соли
Соли состоят из металла и кислотного остатка. В соли, например в сульфате меди (CuSO4), ион металла — меди Сu2+ связан с кислотным остатком серной кислоты SO42-. Соли разделяются в водном растворе, так же как и кислоты и щелочи, частично или полностью на ионы и поэтому проводят электрический ток. Соли получаются при нейтрализации кислоты и щелочи (рис. 38), а также при реакции кислоты с металлом или окислом металла.
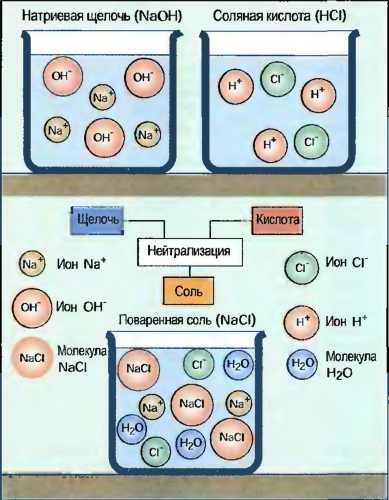
Рис. 38. Образование соли при нейтрализации (схематично)
Химическое название солей указывает на участвовавшую в их происхождении кислоту и металл (табл. 8).
| Таблица 8. Названия сопей | ||
| Кислоты | Соли | Примеры |
| Серная кислота H2SO4 | Сульфаты | Сульфат цинка ZnSO4 |
| Соляная кислота HCl | Хлориды | Хлорид цинка ZnCl2 |
| Углекислота H2CO3 | Карбонаты | Карбонат кальция СаСО3 |
| Азотная кислота HNO3 | Нитраты | Нитрат серебра AgNO3 |
| Кремниевая кислота H2SiO3 | Силикаты | Силикат алюминия Al(SiO2)3 |
| Фосфорная кислота Н2РO4 | Фосфаты | Фосфат кальция Са(РО4)2 |
Сильная кислота вытесняет слабую кислоту из ее соли и образует новую смоль. Если полученные соли растворимы в воде, они могут быть причиной строительных повреждений!
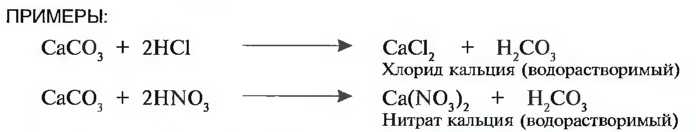
Растворимость солей в воде различна. Тогда как, например, силикаты как основная часть каменных материалов не растворимы или трудно растворимы в воде, вредные для строительства нитраты легко растворяются в воде (табл. 9).
| Таблица 9. Водорастворимость сопей | ||
| Соль | Химическая формула | Растворимость, г/литр |
| Силикат кальция | CaSiO3 | 0,000 |
| Карбонат кальция | СаСO3 | 0,015 |
| Гидрокарбонат кальция | Са(НСO3)2 | 2,000 |
| Сульфат кальция | CaSO4 | 2,500 |
| Сульфат натрия | Na2SO4 | 11,000 |
| Хлорид натрия | NaCl | 36,000 |
| Хлорид кальция | CaCl2 | 75,000 |
| Нитрат кальция | Ca(NO3)2 | 250,000 |
Растворенные в воде соли при испарении воды образуют кристаллы, например сульфат кальция (гипс) и нитрат кальция (стеновая селитра). Они притягивают воду (в кристаллическом состоянии). При этом происходит увеличение объема материала.
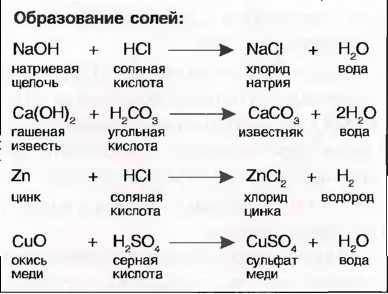
Важные для строительства соли Карбонат кальция (СаСO3) не растворим в воде и является основной составной частью многих природных камней, например известняка и, соответственно, мрамора. Он получается при твердении известкового раствора. Сульфат кальция (CaSO4) или гипс, а также сульфат магния (MgSO4) являются вяжущими веществами. Если они входят в соприкосновение с кислотами, то возникающие при этом новые соли из-за их высокой растворимости в воде и образования кристаллов воды могут привести к строительным повреждениям (вымывание и откалывание материала).
Силикат кальция (CaSiO3) не растворим в воде и получается при твердении гидравлических известей и цементов. Силикат калия (K2SiO3), силикат магния (MgSiO3), силикат кальция (CaSiO3) и силикат алюминия (Al2(SiO3)2) являются составными частями многих каменных материалов. Силикат натрия (Na2SiO3) применяется для производства средств пожаротушения.
Нитрат кальция (Ca(NO3)2), называемый также стеновой селитрой, образуется в навозных траншеях и в хлевах для скота. Он может полностью разрушить строительные конструкции. Кислоты, щелочи и соли начинают действовать только в водных растворах. Тщательная гидроизоляция строительных сооружений в любом виде препятствует проникновению и транспортировке этих веществ и защищает строительное сооружение от повреждений!
Вода
Вода в природе подвержена круговороту. Она испаряется на поверхности земли из рек и морей. Из тумана (водяного пара) образуются облака, которые при охлаждении становятся дождем (рис. 39).
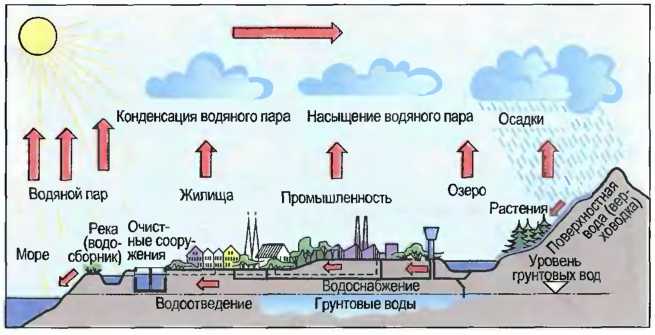
Рис. 39. Круговорот воды в природе
Встречающаяся в природе вода химически не является чистой. Морская вода содержит большее количество различных солей, например поваренной соли (NaCl), сульфата магния (MgSO4) и сульфата натрия (Na2SO4). Содержание солей, например, в Северном море составляет 36 г/литр. Вода с солями кальция называется жесткой. Вода из источников, рек и озер содержит в основном соли кальция и магния. Содержание гидроген-карбоната кальция (Са(НСO3)2) и сульфата кальция (CaSO4), называемое также известковой жесткостью и гипсовой жесткостью, является определяющим для степени жесткости воды. При испарении жесткой воды выделяется гидроген-карбонат кальция в виде каменного осадка на стенках и днище кастрюль. Жесткую воду можно сделать мягкой путем добавки специальных веществ. Дождевая вода, которая вначале состоит из дистиллированной воды, по пути через воздух соприкасается с частичками пыли и копоти, а также с двуокисью углерода (углекислый газ СO2) и с двуокисью серы (SO2) и становится слабокислой («кислотные дожди»). Грунтовая вода — это вода, которая попадает в землю при просачивании осадков в глубоко лежащие слои скальных и нескальных фунтов и заполняет пустоты в земной коре. На пути через слои земли вода очищается от взвесей. Однако она может растворять и принимать другие находящиеся в земле вещества. Она может скапливаться над водонепроницаемыми слоями. Верхняя граница скопления грунтовой воды называется уровнем грунтовых вод. Если грунтовая вода выходит на поверхность, то она образует источник.
Состояния воды Вода — это вещество, которое в природе может быть твердым в виде льда, жидким в виде воды и газообразным в виде пара. Лед тает при О °С (точка плавления). Необходимое для плавления (таяния) 1 кг льда количество тепла составляет 335 кДж (теплота плавления). Вода испаряется при нормальном давлении воздуха при 100 °С (точка кипения). Для испарения 1 кг воды требуется количество тепла в 2250 кДж. Водяной пар конденсируется при охлаждении ниже 100 °С (точка конденсации) в воду (конденсационная вода или конденсат). Она замерзает при 0 °С (точка замерзания) и превращается в лед (рис. 40). Вода при +4 °С имеет наибольшую плотность. Когда она охлаждается до 0 °С и превращается в лед, она расширяется. 10 объемных частей воды соответствуют 11 объемным частям льда. Это встречающееся только у воды свойство называют аномалией воды.
Вода в строительной технике находит широкое применение, например:
- в качестве воды затворения для приготовления свежего бетона и раствора,
- в качестве текучего и транспортирующего средства, например при укладке свежего бетона, а также при твердении бетона,
- при уходе за бетоном после укладки для поливки и орошения бетонной поверхности,
- в качестве растворяющего и диспергирующего средства при изготовлении и укладке красочных слоев и битумных эмульсионных покрытий, а также
- в качестве моющего и поливочного средства для очистки поверхностей строительных конструкций, для очистки инструментов и машин.
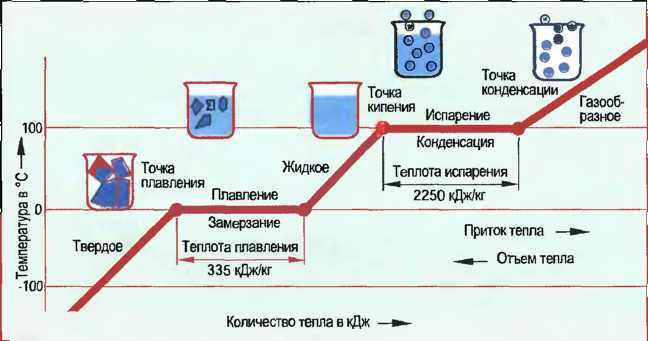
Рис. 40. Агрегатные состояния воды
Вода может приводить также и к повреждениям строительных конструкций, например:
- при дожде за счет восприятия вредных веществ из воздуха и их транспортировки на поверхности строительных конструкций,
- в качестве грунтовой воды и, соответственно, влажности грунта за счет растворения и по большей части капиллярной транспортировки вредных субстанций к строительным конструкциям,
- в качестве водяного пара, который в большинстве случаев попадает в конструкции за счет диффузии, увлажняет конструкцию и тем самым приводит к снижению ее теплозащитных качеств, а также
- в качестве льда, который за счет увеличения объема при замерзании воды создает разрывающее материал давление, которое приводит к откалыванию материала на поверхности строительных конструкций или к провалам на дорогах.
Загрязнение и защита окружающей среды
Под загрязнением окружающей среды понимают загрязнение воздуха, воды и земли вредными веществами. Также и шум загрязняет окружающую среду. Загрязнение окружающей среды не только вредит людям и природе, но также может привести к повреждениям строительных сооружений. Поэтому все занятые на стройплощадке должны учитывать основные положения по охране окружающей среды.
Загрязнение воздуха При сгорании, например, угля, нефти или горючего для двигателей возникают вредные вещества, такие как двуокись углерода (СO2), двуокись серы (SO2), оксиды азота (NO3), которые являются причинами «кислотных дождей» (рис. 43). При испарении углеводороды, находящиеся в составе жидкого топлива и разбавителей, тетрахлоруглерод, находящийся в составе растворителей и чистящих средств, а также фторуглеводороды (FCKW) из газообразного топлива и холодильных установок попадают в воздух. Отдельные вредные вещества в различных пропорциях являются причиной все увеличивающегося потепления земной поверхности вследствие обратного теплового излучения («парниковый эффект») (рис. 41). Тогда как «парниковый эффект» может привести к тяжелым по своим последствиям изменениям климата на земле, разрушающие клетки живой ткани ультрафиолетовые лучи типа В при слишком тонком озоновом слое земной атмосферы могут беспрепятственно достигать земной поверхности, что может привести к опасным для здоровья человека последствиям (рис. 42).
Отдельные вредные вещества образуют вместе с влажностью воздуха сернистые кислоты (H2SO3) или серную кислоту (H2SO4), углекислоту (Н2СO3) и азотную кислоту (HNO3), которые проливаются на землю в виде «кислотных дождей» и влияют на рост растений («умирание лесов»), С другой стороны, они также влияют на значительные повреждения строительных сооружений (рис. 43).
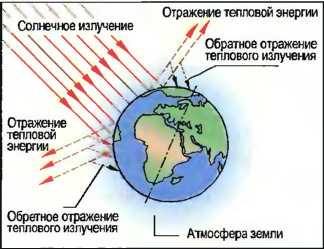
Рис. 41. «Парниковый эффект»
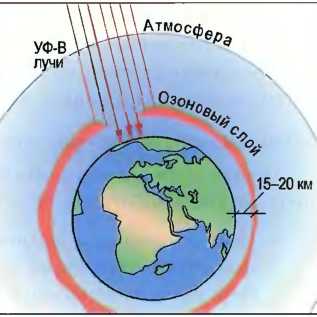
Рис. 42. Озоновый слой
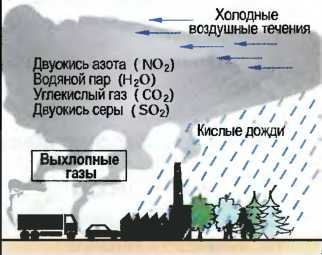
Рис. 43. «Кислотные дожди»
Мероприятия против загрязнения воздуха:
- экономия энергии путем ограничения потребления топлива и улучшения теплоизоляции зданий,
- очистка выхлопных газов путем устройства фильтров и катализаторов,
- использование возобновляемых источников энергии путем работы гидроэлектростанций, ветровых генераторов и солнечных установок.
Загрязнение воды Попадающая и используемая на стройплощадке вода, как правило, отводится в канализацию или непосредственно в землю или в водоемы. Однако эта грязная вода не должна содержать вредные вещества. Вредными считаются:
- те, что ведут к засорению водоотводных каналов и коллекторов, как, например, строительный мусор, раствор или вяжущие вещества;
- те, которые являются пожароопасными, взрывоопасными или ядовитыми, как, например, бензин, растворители, кислоты, щелочи и средства защиты древесины.
Особенно тяжелое загрязнение окружающей среды происходит за счет слива старых масел, мазута, остатков средств защиты древесины и конструкций в землю или в водоемы. Они ведут к отравлению грунтовой воды и к разрушению жизни в естественных водоемах! Эти называемые спецотходами вещества необходимо сдавать специально для этих целей организованным лицензированным организациям, находящимся под строгим государственным надзором!
Загрязнение окружающей среды отходами производства Отходы производства необходимо собирать отдельно как ценные материалы, производственные отходы, подобные домашним отходам, и как спецотходы.
- Ценные материалы, например дерево, металлы, незагрязненный строительный мусор, отделочный асфальт и пластмассы, могут после переработки быть снова использованы.
- Производственные отходы, подобные домашнему мусору, собираются и сжигаются на специальных установках по сжиганию мусора под строгим контролем. При этом получают энергию. Негорючие вещества должны складироваться на специальных гидроизолированных свалках-депониях.
- Спецотходы — это, например, загрязненный материал от сноса старых построек, асбестосодержащие отходы, остатки средств защиты сооружений, средств защиты древесины и опалубочные масла. Перед ликвидацией этих отходов необходимо выполнить требования, установленные законом.
